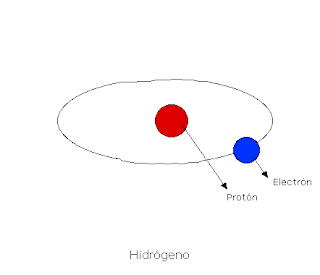
El hidrógeno es el elemento más abundante y ligero de la naturaleza si bien en el
planeta Tierra únicamente se encuentra formando moléculas con otros elementos
como el agua o los hidrocarburos. La producción de hidrógeno, pues, requiere contar
con materia prima que lo contenga y el desarrollo de tecnologías capaces de extraerlo.
En este sentido, una de las primeras experiencias de generación de
hidrógeno data del siglo XIX y corresponde a uno de los padres de la
química actual, Antoine Laurent de Lavoiser, que fue capaz de su
producción a partir de la disociación de la molécula del agua.
Las aplicaciones del hidrógeno a lo largo del tiempo han
evolucionado desde su uso en navegación, como gas de llenado de
globos aerostáticos, a usos por la industria farmacéutica, entre otros.
Clasificación:
Elementos no metálicos: Podemos decir que solo el 20% de los elementos químicos se pueden considerar como no metales. Estos elementos requieren sólo un pequeño número de electrones para alcanzar una estructura estable.
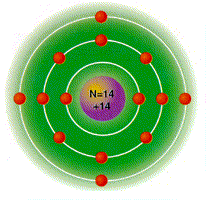
Hidrógeno:Es el elemento mas pequeño que existe, no se puede ubicar bien en la tabla debido a sus propiedades peculiares.
| SEMEJANZAS | DIFERENCIAS | |
| ALCALINOS | Posee sólo un electrón de valencia. | El H posee poca tendencia a perder su electrón en las reacciones químicas, y una gran tendencia a aparearlo. |
| HALÓGENOS | Le falta un electrón para alcanzar su estructura de gas noble. | La electronegatividad del H es muy pequeña. |
| METALES | La mayor parte de las propiedades del H y las de sus compuestos son de sustancias no metálicas. |
Propiedades:
El hidrógeno es un gas incoloro, inodoro y muy poco soluble en todos los disolventes. Es una molécula de masa reducida muy pequeña que a temperatura y presión ordinarias tiene un comportamiento muy parecido al de los gases ideales.
El hidrógeno sólido funde a 14 K y el líquido hierve a 20.4 K.
La energía de disociación (H2 ! 2H) es de 436 kJ/mol.
El hidrógeno también puede combinarse y formar hidrógeno molecular:
H(g) + H(g) ! H2(g) H°= -436.4 kJ Es una reacción fuertemente exotérmica.
El radio covalente del hidrógeno es 0.37 A.
La electronegatividad del hidrógeno es de 2.1 por lo que los enlaces entre éste y los elementos cuya electronegatividad es cercana a 2.1 se consideran no polares. Por ejemplo: H-B, H-Si y H-P. Mientras que los enlaces formados con elementos bastante mayores o menores que 2.1 se dice que son polares. Por ejemplo: H-F, H-Cl y N-H. Estos tipos de enlaces son los que intervienen en el enlace de hidrógeno.
Enlaces:
En algunos compuesto se observa que el hidrógeno interacciona con otros elementos en mayor proporción que la que tendría que tener según los enlaces de Van der Waals. Se dedujo que el átomo de hidrógeno puede ser atraído a la vez por dos o más átomos y actuar como puente.
El enlace de hidrógeno es la interacción intermolecular más intensa y frecuente. Se da, por ejemplo, en sus tres isótopos.
Características:
Los enlaces de hidrógeno se pueden clasificar siguiendo criterios estructurales:
- Enlaces intermoleculares que involucran muchas moléculas.
- Enlaces intermoleculares que implican a sólo dos moléculas en especies dìmeras.
- Enlaces intramoleculares, en el que un átomo de hidrógeno se encuentra enlazado a dos átomos de la misma molécula.
- Existe un caso especial con el ion FHF- ya que adquiere una forma diferente.
- Aumento de la temperatura de ebullición normal y de las entalpìas de fusión y vaporización.
- Disminución de la presión de vapor y el punto de congelación normal.
Las redes que forman estos Hidruros son iònicas y contienen H- que se han formado por la transferencia de electrones desde los átomos metàlicos.
Los Hidruros de los metales alcalinos y alcalinotèrreos poseen composiciones estequiomètricas.
Los Hidruros derivados de los lantànidos ( y seguramente de algunos actìnidos) poseen similitudes con los Hidruros de los metales alcalinos y alacalinotèrreos.
Los Hidruros iónicos se caracterizan por ser sólidos con altos puntos de fusión, de ebullición y de conductividad en estado fundido (si son estables). En general, son insolubles en disolventes ordinarios a temperatura ambiente pero se disuelven sin reaccionar con los haluros fundidos. Los Hidruros menos estables no pueden ser fundidos a presión atmosférica porque sufren disociación, aunque el LiH, que es más estable, funde a 680º. A temperaturas altas son agentes reductores potentes.
El ion hidruro H- actúa como una base de Bronsted muy fuerte ya que acepta fácilmente un protón de un donador.
Hidruros covalentes: en éstos el hidrógeno está enlazado mediante un enlace covalente a un átomo de otro elemento. Se caracterizan por poseer redes moleculares formadas por moléculas covalentes individuales. Se conocen Hidruros covalentes o moleculares de todos los elementos no metàlicos, excepto de los gases nobles, y de los elementos: Al, Ga, Sn, Pb, Sb y Bi, que normalmente tienen carácter más metálico que no metálico. Hay dos tipos de Hidruros covalentes:
- Mononuclear: los simples como el metano y el amoniaco.
- Polinucleares: los que tienen estructura más compleja: (BeH2)x, (AlH3)x.
Hidruros metàlicos: son los compuestos en los que el hidrógeno molecular está unido a metales de transición pero con la característica de que la relación de átomos no es constante, la cantidad de hidrógeno presente no guarda una relación estequiomètrica con el metal al que está unido. Los Hidruros metàlicos se caracterizan por poseer estructuras metálicas y por ser parecidos a las aleaciones en muchas de sus propiedades.
Sus propiedades varían mucho. Suelen tener propiedades metálicas parecidas a las de los metales de los que provienen.

Ejemplo:
El cloro (del griego χλωρος, que significa "verde pálido") fue descubierto en su forma diatómica en 1774 por el sueco Carl Wilhelm Scheele, aunque creía que se trataba de un compuesto que contenía oxígeno. Lo obtuvo a partir de la siguiente reacción:
- 2 NaCl + 2H2SO4 + MnO2 → Na2SO4 + MnSO4 + 2 H2O + Cl2
En 1810 el químico inglés Humphry Davy demuestra que se trata de un elemento físico y le da el nombre de cloro debido a su color. El gas cloro se empleó en la Primera Guerra Mundial, siendo el primer caso de uso de armas químicas como el fosgeno y el gas mostaza.
Clasificación
El cloro es un elemento químico no metal, de número atómico 17 situado en el grupo de loshalógenos (grupo VII A) de la tabla periódica de los elementos. Su símbolo es Cl. En condiciones normales y en estado puro forma dicloro: un gas tóxico amarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el aire, de olor desagradable y tóxico. Es un elemento abundante en la naturaleza y se trata de unelemento químico esencial para muchas formas de vida.

Propiedades:
| Propiedades atómicas | |
|---|---|
| Peso atómico | 35,453 uma |
| Radio medio† | 100 pm |
| Radio atómico calculado | 79 pm |
| Radio covalente | 99 pm |
| Radio de Van der Waals | 175 pm |
| Configuración electrónica | [Ne]3s2 3p5 |
| Estados de oxidación (Óxido) | ±1, +3, +5, +7 (ácido fuerte) |
| Estructura cristalina | Ortorrómbica |
| Propiedades físicas | |
| Estado de la materia | gas (no magnético) |
| Punto de fusión | 171,6 K |
| Punto de ebullición | 239,11 K |
| Entalpía de vaporización | 10,2 kJ/mol |
| Entalpía de fusión | 3,203 kJ/mol |
| Presión de vapor | 1300 Pa |
| Velocidad del sonido | sin datos |
Enlaces:
Enlaces covalentes
Ejemplificaremos, con elementos que existen como moléculas diatómicas.
Cl2, cloro molecular, formado por dos atomos de cloro. Como es un no metal, sus atomos se unen por enlaces covalentes.
.. :Cl: . | El cloro es un elemento del grupo VII A. |
El atomos de cloro solo necesita un electron para completar su octeto. Al unirse con otro atomo de cloro ambos comparten su electron desapareado y se forma un enlace covalente sencillo entre ellos. Este enlace se representa mediante una linea entre los dos atomos.
.. : Cl .. | - | .. : Cl .. |
- Algunos cloruros metálicos se emplean como catalizadores. Por ejemplo, FeCl2, FeCl3, AlCl3.
- Ácido clorhídrico, HCl. Se emplea en la industria alimentaria, metalúrgia, desincrustante, productos de limpieza, abrillantador de pisos, destapador de caños y tuberías.
- Ácido hipocloroso, HClO. Se emplea en la depuración de aguas y alguna de sus sales como agente blanqueante.
- Ácido cloroso, HClO2. La sal de sodio correspondiente, NaClO2, se emplea para producir dióxido de cloro, ClO2, el cual se usa como desinfectante.
- Ácido clórico (HClO3). El clorato de sodio, NaClO3, también se puede emplear para producir dióxido de cloro, empleado en el blanqueo de papel, así como para obtener clorato.
- Ácido perclórico (HClO4). Es un ácido oxidante y se emplea en la industria de explosivos. El perclorato de sodio, NaClO4, se emplea como oxidante y en la industria textil y papelera.
- Compuestos de cloro como los clorofluorocarburos (CFCs) contribuyen a la destrucción de la capa de ozono.
- Algunos compuestos orgánicos de cloro se emplean como pesticidas. Por ejemplo, el hexaclorobenceno (HCB), el para-diclorodifeniltricloroetano (DDT), el toxafeno, etcétera.
- Muchos compuestos organoclorados presentan problemas ambientales debido a su toxicidad, por ejemplo los pesticidas anteriores, los bifenilos policlorados (PCB), o las dioxinas.


Clasificación:
Elemento químico, símbolo Na, número atómico 11 y peso atómico 22.9898. Es un metal suave, reactivo y de bajo punto de fusión, con una densidad relativa de 0.97 a 20ºC (68ºF). Desde el punto de vista comercial, el sodio es el más importante de los metales alcalinos.
Características:
|
El sodio reacciona con rapidez con el agua, y también con nieve y hielo, para producir hidróxido de sodio e hidrógeno. Cuando se expone al aire, el sodio metálico recién cortado pierde su apariencia plateada y adquiere color gris opaco por la formación de un recubrimiento de óxido de sodio.
El sodio no reacciona con nitrógeno, incluso a temperaturas muy elevadas, pero puede reaccionar con amoniaco para formar amida de sodio.
El sodio y el hidrógeno reaccionan arriba de los 200º C (390º F) para formar el hidruro de sodio. El sodio reacciona difícilmente con el carbono, si es que reacciona, pero sí lo hace con los halógenos. También reacciona con varios halogenuros metálicos para dar el metal y cloruro de sodio.
El sodio no reacciona con los hidrocarburos parafínicos, pero forma compuesto de adición con naftaleno y otros compuestos aromáticos policíclicos y con aril alquenos.La reacción del sodio con alcoholes es semejante a la reacción del sodio con agua, pero menos rápida. Hay dos reacciones generales con halogenuros orgánicos. Una de éstas requiere la condensación de dos compuestos orgánicos que contengan halógenos al eliminar éstos. El segundo tipo de reacciones incluye el reemplazo del halógeno por sodio, para obtener un compuesto organosódico.
El sodio, como los restantes metales alcalinos, debido a su gran reactividad al agua, que incluso hace que reaccione con la humedad del aire, en estado puro es necesario conservarlo sumergido en un derivado aceitoso de petróleo, como querosén, aceite lubricante, o vaselina líquida.
En presencia del cloro, basta exponerlo a la luz para que se combine formando cloruro sódico.

Enlaces:
El cloruro de sodio (la sal común) es un ejemplo de enlace iónico: en él se combinan sodio y cloro, perdiendo el primero un electrón que es capturado por el segundo:
-
- NaCl → Na+Cl-
De esta manera forman dos iones de carga contraria: un catión (de carga positiva) y un anión (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacción electromagnética entre los átomos que los mantiene unidos. El enlace iónico es la unión en la que los elementos involucrados aceptarán o perderán electrones.
En una solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como: Na+ + Cl-, mientras que los cristales de cloruro de sodio se marcan: Na+Cl-o simplemente NaCl.


HELIO:
Clasificación:
Elemento químico gaseoso, símbolo He, número atómico 2 y peso atómico de 4.0026. El helio es uno de los gases nobles del grupo O de la tabla periódica. Es el segundo elemento más ligero. La fuente principal de helio del mundo es un grupo de campos de gas natural en los Estados Unidos. El helio es un gas incoloro, inodoro e insípido. Tiene menor solubilidad en agua que cualquier otro gas. Es el elemento menos reactivo y esencialmente no forma compuesto químicos. La densidad y la viscosidad del vapor de helio son muy bajas. La conductividad térmica y el contenido calórico son excepcionalmente altos. El helio puede licuarse, pero su temperatura de condensación es la más baja de cualquier sustancia conocida.
Propiedades:
Propiedades:
Los gases nobles como el helio tienen poca tendencia a participar en reacciones químicas. El helio, como el resto de gases nobles presenta las siguientes propiedades: Es incoloro, inodoro y muestra una reactividad química muy baja en condiciones normales.
El estado del helio en su forma natural es gaseoso. El helio es un elmento químico de aspecto incoloro y pertenece al grupo de los gases nobles. El número atómico del helio es 2. El símbolo químico del helio es He. El punto de fusión del helio es de 0 grados Kelvin o de -272,2 grados celsius o grados centígrados. El punto de ebullición del helio es de 4,22 grados Kelvin o de -268,93 grados celsius o grados centígrados.
Propiedades atómicas:
La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el helio dentro de la tabla periódica de los elementos, el helio se encuentra en el grupo 18 y periodo 1. El helio tiene una masa atómica de 4,0026 u. La configuración electrónica del helio es 1ss. La configuración electrónica de los elementos, determina la forma el la cual los electrones están estructurados en los átomos de un elemento. El radio de Van der Waals del helio es de 1,0 pm. El helio tiene un total de 2 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones.

Enlaces:
El helio normalmente presenta número de oxidación cero, y parece tener una débil tendencia a unirse a otros elementos: flúor (difluoruro de helio), neón (HeNe). También se han estudiado especies como He+ y He2+. Algunas aleaciones como HgHe10 y Pt3He pueden considerarse clatratos.
Entre sus usos destacan:
Entre sus usos destacan:
- gas inerte en soldadura de arco;
- atmósfera para crecimiento de cristales de silicio y germanio y en la producción de titanio y circonio;
- refrigerante de reactores nucleares, ya que transfiere el calor , no se hace radiactivo y es químicamente inerte;
- gas de túneles de viento supersónicos;
- llenado de globos de observación y otros utensilios más ligeros que el aire;
- Una mezcla de helio y oxígeno se usa como atmósfera artificial para buceo y otros trabajos bajo presión: no es soluble en la sangre, previene la narcosis del nitrógeno. Se emplean diferentes proporciones de He/O2 para diferentes profundidades. Para baja presión y con fines terapéuticos: 80% He; 20% O2;
- llenado de globos y dirigibles ya que es más seguro (no inflamable) y con un 93% del poder elevador del que el hidrógeno;
- recientemente, para presurizar el combustible líquido de cohetes, (un cohete Saturno requiere alrededor de 3,7x1011 litros para el lanzamiento;
- helio líquido se usa en resonancia magnética utilizada en medicina, lo que ha evitado la necesidad de cirugía exploratoria para el diagnóstico de pacientes. Otra aplicación médica utiliza resonancia magnética para determinar si un paciente tiene alguna forma de cáncer.
- El uso como refrigerante en superconductividad caerá en el futuro con el descubrimiento de materiales superconductores de alta temperatura. Entre las aplicaciones en auge se encuentra su uso en radares (detección de misiles crucero a baja altura, etc.).

CARBONO:
El carbono es un elemento químico de número atómico 6 y símbolo C. Es sólido a temperatura ambiente. Dependiendo de las condiciones de formación, puede encontrarse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma degrafito o diamante. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
Clasificación:
Carbono, de símbolo C, un no metal, es un elemento crucial para la existencia de los organismos vivos, y que tiene muchas aplicaciones industriales importantes. Su número atómico es 6; y pertenece al grupo 14 (o IV A) del sistema periódico.
Propiedades:
Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento.
Un gran número de metales se combinan con el elemento a temperaturas elevadas para formar carburos.
Con el oxígeno forma tres compuestos gaseosos: monóxido de carbono, CO, dióxido de carbono, CO2, y subóxido de carbono, C3O2.
Los dos primeros son los más importantes desde el punto de vista industrial.
El carbono es un elemento único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados.
El grupo más grande de estos compuestos es el constituido por carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Aunque la clasificación no es rigurosa, el carbono forma otra serie de compuestos considerados como inorgánicos, en un número mucho menor al de los orgánicos.
Las tres formas de carbono elemental existentes en la naturaleza (diamante, grafito y carbono amorfo) son sólidos con puntos de fusión extremadamente altos, e insolubles en todos los disolventes a temperaturas ordinarias. Las propiedades físicas de las tres formas difieren considerablemente a causa de las diferencias en su estructura cristalina.
En el diamante, el material más duro que se conoce, cada átomo está unido a otros cuatro en una estructura tridimensional, mientras que el grafito consiste en láminas débilmente unidas de átomos dispuestos en hexágonos.
El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire.
El carbono tiene la capacidad única de enlazarse con otros átomos de carbono para formar compuestos en cadena y cíclicos muy complejos. Esta propiedad conduce a un número casi infinito de compuestos de carbono, siendo los más comunes los que contienen carbono e hidrógeno.
Enlaces:
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
Enlace simple: Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
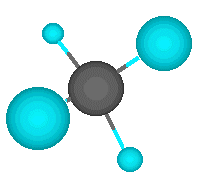
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.
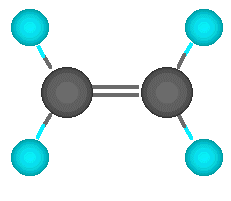
Enlace doble:El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otrs dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.
Enlace triple:Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar el enlace triple con otros elementos como el nitrógeno.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar el enlace triple con otros elementos como el nitrógeno.




No hay comentarios:
Publicar un comentario